OXYGÈNE
-
LE 9.03.2020: Actualité de la science / L'oxygène: la couleur de la vie.
- Par dimitri1977
- Le 04/05/2020
- Dans Actualité de la météo,de l'astronomie et de la sciences à la une du jour
- 0 commentaire
L'oxygène: la couleur de la vie
Le huitième élément de la nature nous permet de vivre, de respirer et de penser, mais il colore également le cosmos avec sa teinte verdâtre distinctive.
Par Bob Berman | Publication: jeudi 29 août 2019
La plupart des gens qui regardent la nébuleuse d'Orion (M42) à travers de grands télescopes amateurs voient une teinte verdâtre de l'oxygène incandescent, capturée ici à travers un filtre qui passe cette couleur. Les images M42 typiques révèlent le rouge émis par l'hydrogène.
ESO
Lorsque nous observons des objets dans l'espace lointain à travers des télescopes d'arrière-cour, nous ne voyons généralement pas beaucoup de couleurs. La grande exception est le vert vif dans certaines nébuleuses. Le secret de cette couleur constitue une histoire majeure. C'est un conte qui se connecte à nos vies et à nos esprits, et ouvre des portails à un nouveau niveau d'exploration céleste.
Revenez à la classe de sciences de sixième année de Mme Wombat. Là, nous avons appris que l'univers contient 92 éléments naturels. Tous se trouvent également ici sur Terre. Cela n'a aucun sens de prétendre qu'ils sont tout aussi intéressants. Par exemple, chaque respiration que vous prenez est un mélange gazeux de 99,9% d'azote, d'oxygène et d'argon. L'argon est inerte et flotte juste là. Nous ne l'utilisons pas pour grand-chose à part le remplissage des ampoules. Cela ne nous aide pas et
ne nous fait pas de mal.L'air contient également un peu de vapeur d'eau (H2O), qui représente les deux tiers de l'hydrogène. C'est l'élément le plus commun de l'univers, a insisté Mme Wombat, et qui étions-nous pour douter d'elle? L'hydrogène constitue la majeure partie de notre cerveau. C'est le carburant principal du Soleil. C'est évidemment crucial pour notre existence.
Mais maintenant, en termes d'abondance cosmique, considérons l'élément numéro deux: l'hélium. Cela nous ramène à la catégorie non vitale. Nos corps contiennent exactement zéro hélium. Si tout l'hélium de la Terre disparaissait soudainement, la plupart d'entre nous ne s'en rendraient pas compte ou ne s'en soucieraient pas.
Mais donnez de l'hélium: à l'intérieur des étoiles, il subit une fusion pour créer le troisième élément le plus abondant de l'univers, l'oxygène. Nous avons ainsi atteint le héros du conte d'aventure d'aujourd'hui. Nos vies dépendent de façon critique de l'oxygène. Il se combine si ardemment avec d'autres éléments que lorsque nous regardons autour de nous, sur Terre ou à travers nos télescopes, nous le voyons presque partout. Bien que l'eau puisse représenter les deux tiers de l'hydrogène en termes de composition atomique, elle représente près de 90% d'oxygène en poids. De la même façon, les anneaux de Saturne sont principalement de l'oxygène. Les nuages aussi. Et du lait au chocolat. Chatons.
Cette image à peu près vraie couleur de la nébuleuse planétaire Haltère (M27) montre l'oxygène rougeoyant comme vert et l'hydrogène comme rouge.
ESO
Parce que la plupart des autres éléments fusionnent facilement avec elle et l'absorbent comme une éponge, aucun corps céleste n'a d'oxygène libre significatif. L'atmosphère de la Terre est le seul endroit de l'univers connu qui en contient beaucoup.
Notre couverture d'air contient 21% d'oxygène pour une seule raison: les plantes. Ils absorbent l'oxygène sous l'une de ses formes combinées (dioxyde de carbone), utilisent le carbone pour créer leurs corps rigides et croquants, puis libèrent de l'oxygène moléculaire en tant que déchet. Il y a tellement de plantes, d'arbres et de varech, notre air est rempli d'oxygène.
Personne ne le savait au début de la Renaissance. En fait, personne ne savait que l'air est un mélange de gaz. Mais la chasse au savoir était lancée. Les scientifiques ont découvert les deux principaux composants de l'air presque simultanément. Le médecin écossais Daniel Rutherford a identifié l'azote en 1772; deux ans plus tard, le théologien britannique Joseph Priestly a isolé l'oxygène. La distinction principale des éléments était immédiatement évidente. Un a soutenu la vie et la combustion; l'autre non.
Le grand joueur non oxygéné acquit bientôt une réputation macabre. Rutherford l'a appelé «l'air nocif». Les souris placées dedans sont rapidement mortes. Quant à l'oxygène, c'était le précieux élément vital que tout le monde essayait alors de détecter. Parce que l'oxygène se lie si facilement à la plupart des autres éléments, il représente les deux tiers du corps animal en poids. Et près de la moitié de la Lune. Quand les loups hurlent à la pleine lune, c'est essentiellement de l'oxygène qui appelle l'oxygène.
Les plantes et les arbres pompent de l'oxygène dans l'atmosphère, permettant aux humains de respirer - et aux aurores de briller.
Elenathewise / iStock / Thinkstock
Trop de bonne chose
Au début, l'univers n'avait pas d'oxygène du tout. Le Big Bang a créé de l'hydrogène, de l'hélium et un peu de lithium au cas où les premières étoiles souffriraient de dépression. Mais pas de O. Il est apparu oh-so progressivement commençant peut-être 100 millions d'années après le Big Bang - une infiltration pathétique, vraiment, qui s'est infiltrée après avoir été forgée dans les intérieurs invisibles des étoiles. Certains de ces premiers soleils bleus se sont retournés à l'envers en faisant exploser violemment et en dispersant leur oxygène nouvellement fabriqué à travers les ruelles sans plancher de l'espace.
L'astrophysicien britannique Arthur Eddington a découvert pour la première fois comment le Soleil et d'autres étoiles brillent en 1920. Il a correctement soutenu que l'énergie provenait de la fusion de quatre atomes d'hydrogène en un nouvel atome d'hélium. À mesure que les étoiles évoluent vers la vieillesse, elles fusionnent de plus en plus d'hélium pour produire du carbone, puis de l'oxygène. Au moment où une étoile comme le Soleil atteint la fin de sa vie et s'effondre en une naine blanche, c'est une boule solide d'oxygène et de carbone et rien d'autre.
Avant que cet écrasement ne se déroule, une étoile typique avec jusqu'à environ 8 masses solaires jette du matériel sous forme de bulle de gaz en expansion. C'est là que nous en tant qu'observateurs entrons en scène. Chaque fois que nous regardons une nébuleuse planétaire, nous voyons une étoile centrale de vieillesse entourée d'un beignet brillant contenant d'innombrables milliards de tonnes d'oxygène. Certains d'entre eux - ainsi que du matériel provenant de l'explosion de supernova dans des étoiles encore plus massives - aident finalement à former de nouvelles étoiles et planètes.
Comme le nôtre. Bien que, fait intéressant, nous n'avions pas d'atmosphère oxygénée il y a seulement 2,4 milliards d'années. Ensuite, les choses ont commencé à devenir incontrôlables. Il y a à peine 300 millions d'années, la Terre était tellement recouverte de plantes que notre air s'est suroxygéné. Il a atteint une concentration de 35%. Cela a laissé l'évolution créer une ère cauchemardesque d'insectes hypergéants. Certaines mouches à l'époque avaient des envergures qui pourraient rivaliser avec les aigles d'aujourd'hui. Essayez de les tapoter. Parfois, trop d'oxygène n'est pas une bonne idée.
La lanterne verteNous sommes des observateurs, cependant, le vrai truc est de savoir comment l'oxygène nous amène à de jolies couleurs. (En fait, bien qu'il s'agisse d'un gaz incolore, l'oxygène se liquéfie en un fluide bleu attrayant.) Sous sa forme gazeuse, l'oxygène ne brille généralement pas. Pas quand c'est cool. En effet, un atome ne peut émettre de lumière que lorsqu'un électron en orbite se rapproche du noyau. Les atomes tranquilles ordinaires, comme ceux des gaz que vous respirez, ne sont pas excités, donc leurs électrons ne changent pas d'orbite et ne brillent pas.
Le vert domine souvent l'éclat d'une aurore. La lumière provient de l'oxygène atomique dans la fine atmosphère supérieure de la Terre, à environ 60 miles (100 kilomètres) au-dessus de la surface.
Hinrich Bäsemann
Regardez maintenant dans le ciel nocturne. Notre première expérience fonctionne mieux si vous déménagez en Alaska, au Canada, en Islande ou en Europe du Nord. C'est là que vous pouvez voir le gaz rougeoyant le plus proche - les célèbres aurores boréales ou aurores boréales. Bien qu'ils soient au cœur de notre histoire, les mystères de l'aurore ont poussé les physiciens bonkers au cours du 19e siècle et jusque dans le 20e. De quoi s'agit-il exactement et comment émet-il sa couleur verte distinctive? Les spectroscopes, qui séparent la lumière d'un objet en ses couleurs composantes, ont révélé que la plupart des lumières aurorales avaient une longueur d'onde précise de 557,7 nanomètres. Mais, étrangement, comparer cela à divers gaz incandescents dans le laboratoire n'a donné aucune réponse. Rien ne correspondait.
Les physiciens étaient en ébullition. Chaque explication s'est avérée incorrecte. Au début du XXe siècle, l'astronome allemand Julius Scheiner a conclu que «le spectre auroral est absolument identique au spectre cathodique de l'azote». Bip, faux! Le météorologiste anglais Marshall Watts était tout aussi ferme dans une opinion antithétique: "Il ne fait maintenant aucun doute que la [lueur de] l'aurore doit être attribuée au krypton." Bip! Les idées fausses coulaient à flots. Quelques années plus tard, l'expert allemand de la spectroscopie Heinrich Kayser leva les mains avec exaspération: "Nous ne savons rien du tout de l'origine chimique des raies de la lumière polaire."
Pourtant, tout le monde avait une opinion. Le chercheur allemand Alfred Wegener, bientôt célèbre pour sa théorie de la dérive des continents, a publié un ouvrage majeur sur l'atmosphère dans lequel il a suggéré que la lueur aurorale provenait d'un nouveau gaz de «géocoronium». Cette notion d'un élément non découvert produisant un feu vert n'était pas nouvelle. Pendant près d'un siècle, les scientifiques ont largement attribué la lueur verte étrange des nébuleuses - qui brillent à une longueur d'onde émeraude de 500,7 nm - à une substance appelée «nébulium». Le cosmos semblait inondé d'éléments introuvables sur Terre.
Des décennies se sont écoulées. Lars Vegard, un expert norvégien de la physique des aurores, était sûr d'avoir résolu le casse-tête vert en 1924. Comme il l'a écrit dans Nature, «le spectre auroral typique est émis à partir de [particules de poussière solides] d'azote».
Ils avaient tous tort. Il s'est avéré que l'élément nébulium n'existe pas, pas plus que le géocoronium. Pendant tout ce temps, la source du feu vert était de l'oxygène ordinaire.
Dans les deux endroits - espace profond et haut dans notre atmosphère - le mystère est né des conditions de quasi-vide. Vous voyez, comme Mme Wombat le faisait remarquer, les électrons de l'oxygène ont certaines orbites autorisées autour du noyau. Mais lorsqu'ils sont excités par les électrons solaires ou le rayonnement ultraviolet à haute énergie d'une étoile, les électrons sautent vers des positions énergétiques mais instables où ils ne peuvent pas rester. Près de la surface de la Terre où l'air est épais, ces atomes excités frappent les autres si rapidement qu'ils dissipent leur énergie supplémentaire avant de pouvoir la diffuser sous forme de lumière.
Mais dans la haute atmosphère raréfiée et aussi dans le vide poussé de l'espace profond, les électrons de l'oxygène peuvent s'attarder dans un état «métastable» avant de tomber sur une orbite inférieure et d'émettre des photons. Ils dégagent ainsi des couleurs jamais produites dans des conditions plus terrestres. Ce «rayonnement interdit», comme on l'appelait, se présente dans une nuance précise de jaune-vert à 557,7 nm dans les aurores boréales et de bleu-vert à 500,7 nm pour les nébuleuses planétaires. (Cette dernière émission provient de l'oxygène doublement ionisé, qui a perdu deux de son complément normal d'électrons.) Oxygène. Rien d'exotique, après tout ce mal. Le mystère est enfin résolu.
Bien que la lueur verte de l'oxygène domine cette aurore, elle affiche également des teintes violettes des molécules d'azote.
Justinreznick / iStock / Thinkstock
Oh dis, tu le vois?
Heureusement, ces émissions d'oxygène se produisent là où l'œil humain est le plus sensible. Pourtant, en 2014, lors de ma tournée annuelle des aurores boréales en Alaska, que je conduis depuis des décennies, certains des 44 invités ont déclaré n'avoir vu aucune couleur. Pour eux, l'aurore est apparue blanc pâle. J'ai été surpris car à mes yeux, le vert était si intense qu'il ressemblait à un feu de circulation. J'ai donc pris un vote. Résultat: la moitié du groupe a vu la couleur comme un vert riche; un quart le percevait comme vert pâle; et un quart ne voyait aucune couleur. Il est ainsi apparu une fois de plus que les yeux humains varient dans leur capacité à voir la couleur à de faibles niveaux de lumière.
Cette individualité se transmet aux observations télescopiques. La plupart des gens qui regardent la nébuleuse d'Orion (M42) à travers de grands instruments de jardin - 10 pouces d'ouverture et plus - perçoivent une couleur verte distincte. Mais tout le monde ne le fait pas. Les nébuleuses les plus fiables qui affichent une couleur verte riche sont probablement des planètes compactes telles que la nébuleuse de l'œil de chat (NGC 6543) à Draco et la nébuleuse de la petite gemme (NGC 6818) en Sagittaire. J'avais l'habitude de déplorer que puisque la plupart des amateurs ne possèdent pas de spectroscopes, ils ne peuvent pas examiner et apprécier pleinement ces teintes. Récemment, cependant, j'ai réalisé que lorsqu'un corps céleste émet la plupart de sa lumière dans une partie étroite du spectre - comme le font les planétaires avec leur oxygène brillant à 500,7 nm - vous n'avez vraiment pas besoin d'un spectroscope. Votre œil perçoit des couleurs précises à travers l'oculaire.
Un spectroscope est très utile pour observer des mélanges de couleurs. En utiliser un pour regarder Betelgeuse ou Sirius est une expérience merveilleuse car non seulement toutes les émissions sont présentées côte à côte de manière dramatique, mais les différences entre les types spectraux stellaires deviennent également magnifiquement frappantes. Bételgeuse montre de nombreuses raies d'absorption, même certaines provenant de molécules, tandis que Sirius affiche une simple série de raies pointues d'hydrogène superposées à une explosion vive de vert, bleu et rouge. En revanche, une nébuleuse planétaire est une composition à une seule note avec pratiquement toute sa lumière provenant de cette seule ligne verte d'oxygène.
Un motif en spirale intrigant s'est développé dans cette aurore au-dessus du musée Lofotr Viking sur l'île norvégienne de Vestvågøya.
Allen Hwang
Avec la nébuleuse d'Orion, l'oxygène brillant domine la vue visuelle de l'oculaire en conférant une couleur de jade évidente. À travers un spectroscope, cependant, d'autres émissions apparaissent parce que l'hydrogène rougeoyant et la lumière stellaire dispersée remplissent également le pot de ragoût. Pour terminer le quart de travail, prenez une photo. Maintenant, une chose surprenante se produit - le vert disparaît. Il a disparu parce qu'il est «grillé» et surexposé en blanc. Soudain, la lumière cramoisie de l'hydrogène à 656,3 nm règne. Cette couleur ne s'enregistre pas à travers un oculaire visuel car à faible niveau, la vision humaine est complètement aveugle au rouge foncé.
Conclusion: les couleurs que vous voyez - et la question de savoir si la lueur verte de l'oxygène domine la scène - dépendent de votre technique. Visuellement, l'oxygène règne. Photographiquement, ce n'est pas le cas dans les nébuleuses planétaires. Et spectroscopiquement, c'est un coup de tête sauf avec les planétaires. À travers tout cela, et quel que soit l'équipement que vous utilisez, l'observation de l'oxygène incandescent est éducative et amusante.
Les trois isotopes sagesL'oxygène fournit également les clés des énigmes célestes critiques. C'est parce qu'il se décline en trois saveurs. L'oxygène a trois isotopes stables, chacun ayant le même nombre de protons mais un nombre différent de neutrons dans son noyau. Tous ont des propriétés chimiques identiques et vous pouvez en respirer avec joie. Chaque atome d'oxygène contient huit protons. La grande majorité d'entre eux possède également huit neutrons. Additionnez les protons et les neutrons dans cet atome d'oxygène le plus léger et vous obtenez 16, donc cette forme la plus courante est appelée O-16. Mais un petit pourcentage d'oxygène a un ou deux neutrons supplémentaires - O-17 et O-18, respectivement.
Les premières étoiles de l'univers ont créé du O-16 pur à 100%. Les générations ultérieures ont progressivement augmenté les proportions des isotopes les plus lourds. De nos jours, au moins ici dans le système solaire, environ 1 sur 500 atomes d'oxygène contient un neutron supplémentaire tandis qu'environ 1 sur 2000 en a deux supplémentaires. Toujours avec nous?
Les étoiles d'Orion brillent à travers les rayons lumineux de cette aurore verdâtre riche en oxygène.
Stéphane Vermette
Les rapports des isotopes O-16, O-17 et O-18 dans chaque croustille, chiot et roche ici sur Terre suivent une relation simple. Mais si vous envoyez un atterrisseur sur Mars et échantillonnez son matériel, comme la NASA l'a fait à plusieurs reprises, vous constaterez que les roches martiennes avec le même rapport O-18 à O-16 que les spécimens terrestres auront un rapport légèrement plus élevé de O-17 à O-16. La différence dans le rapport isotopique entre nos deux planètes est de 300 parties par million, avec Mars toujours plus élevé.
Les isotopes de l'oxygène sont donc comme des empreintes digitales. Ils vous disent de quel monde vient un rocher. C'est ainsi que nous pouvons être sûrs qu'une météorite particulière est originaire de la planète rouge. Nous avons également des météorites du grand astéroïde Vesta, dont le rapport O-17 à O-16 est inférieur d'environ 300 parties par million à celui de la Terre.
Voici où les choses deviennent étranges. L'oxygène dans les roches lunaires a le même rapport isotopique que les objets terrestres. C'est comme si la Lune était la Terre! Toute différence est inférieure à 1 partie sur 50 000.
Cela pose cependant un problème. Presque tous les scientifiques planétaires pensent que la Lune est le résultat d'une collision depuis longtemps entre la Terre et un corps de la taille de Mars surnommé Theia. Les lois de la physique montrent que pour que l'hypothèse d'impact fonctionne, une grande partie de la Lune devrait être du matériau Theia et devrait donc avoir un rapport isotope-oxygène distinct et étranger. Pourtant, la Lune semble faite de choses terrestres.
Toutes les quelques années, certains chercheurs publieront un article de journal qui tente d'expliquer ce problème d'oxygène ou bien de l'utiliser pour discréditer l'hypothèse de collision. Une nouvelle analyse majeure des roches lunaires d'Apollo en 2014 a prétendu trouver une minuscule disparité entre les oxygènes de nos mondes - à peine peut-être, à peine, pour garder vivante l'idée de la naissance violente de la Lune.
Alors, respirez profondément. Méditez sur l'élément qui dynamise votre cerveau afin que vous puissiez contempler le cosmos. Et un jour, si nous apercevons la lueur aurorale distinctive de l'oxygène sur une exoplanète, le feu vert peut servir de signal «go».
Car, presque sûrement, nous aurons trouvé la signature des plantes sur un autre monde. Ce sera notre oxygène bien-aimé, guidant une fois de plus nos découvertes.
-
LE 23.01.2020: Actualité de la météo,de l'astronomie et de la science/ Pour la colonisation de la Lune, l’ESA teste une centrale à oxygène.
- Par dimitri1977
- Le 23/01/2020
- Dans Actualité de la météo,de l'astronomie et de la sciences à la une du jour
- 0 commentaire
Pour la colonisation de la Lune, l’ESA teste une centrale à oxygène
Nathalie Mayer
Journaliste
Être capable de produire de l'oxygène à partir de ressources naturellement présentes sur la Lune semble indispensable à la future colonisation de notre satellite. Et des ingénieurs de l'Agence spatiale européenne (ESA) annoncent aujourd'hui être sur la bonne voie. Grâce à leur centrale test, ils sont capables d'extraire l'oxygène contenu dans le régolithe lunaire.
Sur la Lune, les impacts de météorites ont laissé derrière eux une couche de poussières que les astronomes appellent le régolithe. Il a tendance à provoquer toutes sortes de problèmes techniques aux engins qui se posent sur notre satellite. Il pourrait aussi causer des problèmes de santé aux astronautes qui doivent retourner prochainement sur la Lune. Mais les ingénieurs l'envisagent aujourd'hui surtout comme une ressource naturelle abondante.
Il y a quelques mois, ils imaginaient construire avec, les briques des futures bases lunaires. Et pourquoi ne pas en extraire l’oxygène nécessaire aux prochains explorateurs de notre satellite ? L'Agence spatiale européenne (ESA) annonce même avoir installé, au cœur de son Centre européen de technologie spatiale (Pays-Bas), une centrale prototype destinée à montrer la faisabilité de ce dernier projet.
Les échantillons de régolithe que de précédentes missions ont ramenés de la Lune confirment que le matériau est composé de 40 à 45 % d'oxygène en poids. L'ennui, c'est que, dans le régolithe, l'oxygène apparaît sous forme d'oxydes, chimiquement lié à d'autres éléments. Et donc, non disponible.

À gauche, un petit tas de régolithe lunaire. Ou du moins, de régolithe lunaire tel que reconstitué par les ingénieurs de l’ESA. À gauche, le même tas de régolithe après extraction de son oxygène. On y discerne les alliages métalliques produits dans l’opération. © Beth Lomax, Université de Glasgow
Une centrale à oxygène pilote, dès le milieu des années 2020
Ainsi, pour extraire l'oxygène du régolithe lunaire, les ingénieurs de l'ESA comptent sur une technique appelée l'électrolyse en milieux de sels fondus. Le régolithe est placé dans une enceinte en métal contenant du chlorure de calcium (CaCl2) fondu. Le tout est chauffé à 950 °C. Le régolithe demeure solide. Mais lorsque l'on y fait passer un courant, l'oxygène est extrait et migre à travers le sel pour être collecté du côté de l'anode. En parallèle, le restant de régolithe est également converti en alliages métalliques.
D'autres techniques existent. Mais elles se révèlent moins rentables ou demandent de monter à des températures de plus de 1.600 °C. Cette technique semble la plus prometteuse. Elle est d'ailleurs déjà exploitée industriellement. Mais pas pour la production d'oxygène qui, dans ce cas, fait plutôt figure de sous-produit indésirable. Il a donc fallu, aux ingénieurs de l'ESA, imaginer un tuyau d'échappement pour permettre de libérer l'oxygène en un point donné. Dans les prochaines évolutions, il est prévu, bien sûr, que l'oxygène soit stocké en sortie de process.
“
Extraire 96 % de l’oxygène du régolithe
Comme l'objectif est de renvoyer des Hommes sur la Lune dans les années à venir, pour y demeurer, cette fois, l'idée est bien de peaufiner la technologie. Pour en réduire la température de fonctionnement, par exemple. Et pour faire la démonstration d'une usine pilote d'ici le milieu des années 2020. Pour l'heure, les ingénieurs de l'ESA affirment être capables d'extraire 96 % de l'oxygène du régolithe en 50 heures d'opération. Mais déjà 75 % en seulement 15 heures.
CE QU'IL FAUT RETENIR
- Bientôt, des êtres humains partiront pour coloniser la Lune.
- Pour préparer l’expédition, l’Agence spatiale européenne (ESA) a construit une centrale à oxygène du côté des Pays-Bas.
- Objectif : montrer qu’il est possible d’extraire de l’oxygène du régolithe lunaire. Et suffisamment pour subvenir aux besoins des futurs colons.
POUR EN SAVOIR PLUS
Colonisation de la Lune : une méthode prometteuse pour y produire de l'oxygène
Le régolithe lunaire contient des oxydes métalliques en abondance et l'on sait depuis des décennies que l'on pourrait extraire d'importantes quantités d'oxygène de ce sol. Une méthode particulièrement prometteuse par électrochimie a finalement été mise au point, fournissant en bonus des alliages métalliques. Elle sera peut-être utilisée par les futurs colons lunaires.
Article de Laurent Sacco paru le 14/10/2019

Une vue du cratère Shorty lors de la mission Apollo 17. © Nasa
Une base lunaire aurait bien des avantages. Le champ de gravité de la Lune étant plus faible que celui de la Terre, l'extraction de matériaux permettant de construire les fameuses colonies spatiales de Gerard O'Neill y serait plus aisée. Avec une biosphère en réduction, elle permettrait de tester certains des concepts nécessaires à l'établissement d'une base permanente et autonome pour des colons martiens. Mais pour cela, il faudrait pouvoir faire vivre une population humaine non négligeable et cela implique de pouvoir disposer de ressources en oxygène et en eau.
Nous avons de bonnes raisons de penser qu'il existe des ressources en eau dans certains cratères lunaires aux pôles. Mais nous ne savons pas en pratique si elles seront vraiment adaptées à la colonisation.
En ce qui concerne l'oxygène, nous savons depuis les travaux de pionniers, dans les années 1960, qu'il est possible de l'extraire du sol lunaire. En effet, le régolithe et les roches sur la Lune contiennent beaucoup d'oxygène sous forme d’oxyde métallique de fer, de titane et bien sûr de silicium, formant des minéraux. Au cours des décennies qui ont suivi le programme Apollo, une vingtaine de processus physico-chimiques ont été proposés pour produire de l'oxygène sur la Lune.
Une présentation des études faites par l'ESA sur le régolithe lunaire. Pour obtenir une traduction en français assez fidèle, cliquez sur le rectangle blanc en bas à droite. Les sous-titres en anglais devraient alors apparaître. Cliquez ensuite sur l'écrou à droite du rectangle, puis sur « Sous-titres » et enfin sur « Traduire automatiquement ». Choisissez « Français ». © European Space Agency, ESA
Des procédés pour extraire l'oxygène du sol lunaire avec l'énergie solaire
Parmi les plus étudiés, avec diverses variantes, on trouve ceux consistant à utiliser une sorte de four solaire avec des miroirs concentrant les rayons du Soleil pour porter à des températures élevées (entre 700 et 1 000 °C) du régolithe ou des roches, éventuellement collectés et amenés dans le four par des robots. Certains minéraux - comme l'ilménite de formule FeTiO3 - peuvent alors réagir avec de l'hydrogène ou du méthane pour produire presque directement de l'oxygène ou du monoxyde de carbone et de l'hydrogène. À plus basse température, le monoxyde de carbone et l'hydrogène donnent alors du méthane et de l'eau que l'on peut électrolyser pour obtenir de l'oxygène et de l'hydrogène. Méthane ou hydrogène, selon la réaction de départ, peuvent donc être réutilisés pour boucler un cycle de production d'oxygène. Il faudrait bien sûr apporter suffisamment de méthane ou d'hydrogène en provenance de la Terre pour amorcer un tel cycle.
Une autre grande classe de processus repose, elle, sur l'électrolyse d'un bain de roches lunaires silicatées fondues. Dans les deux cas de figure, on a besoin d'énergie solaire pour chauffer et produire de l'électricité, ce qui ne devrait pas poser de problème sur la Lune. L'électricité pourrait, de plus, servir à alimenter des sortes de catapultes magnétiques qui permettraient d'envoyer dans l'espace, aussi bien des réserves d'oxygène liquide, pour des colonies spatiales ou pour la propulsion de vaisseaux en orbite destinés à exploiter les astéroïdes, que des matériaux issus de l'industrie lunaire, par exemple les métaux produits indirectement par l'extraction de l'oxygène.
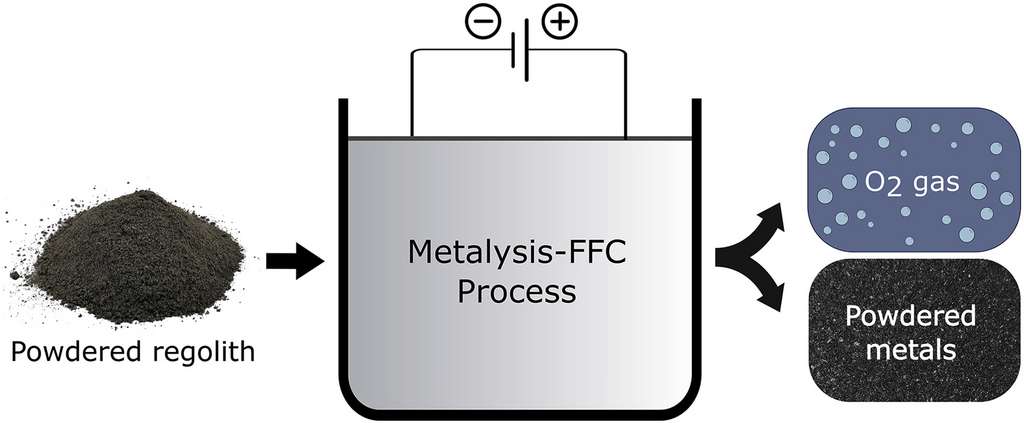
Un schéma de la méthode basée sur le procédé FFC permettant de passer du régolithe en poudre (powdered regolith) à la poudre de métaux. © Lomax et al., Planetary and Space Science, 2019
L'ESA vient de faire savoir qu'une nouvelle technique d'électrolyse très prometteuse venait d'être découverte par une chimiste de l'université de Glasgow, Beth Lomax, dont les recherches doctorales ont été soutenues par l'agence européenne. Beth Lomax et ses collègues ont d'ailleurs publié leurs travaux à ce sujet dans un article du journal Planetary and Space Science.
L'idée derrière la nouvelle méthode électrochimique est une variante de celle développée depuis sa découverte en 1996-1997 à l'université de Cambridge par George Chen, Derek Fray and Tom Farthing. Elle est pour cette raison connue sous le nom de procédé FFC et ses découvreurs ont vendu le brevet à des entrepreneurs canadiens et britanniques, James Reimer et Ray Power, qui ont fondé une entreprise pour exploiter son potentiel : Metalysis. Le procédé FFC permet d'exploiter des composés métalliques solides, en particulier des oxydes, qui sont réduits de manière cathodique en métaux ou alliages respectifs à partir de sels fondus.
Beth Lomax a conduit ses recherches aussi en association avec Metalysis. Les échantillons de roches lunaires étant trop précieux pour ce genre d'expérience d'extraction de l'oxygène à partir des oxydes métalliques du régolithe lunaire (rappelons que celui-ci contient de 40 à 45 % de son poids en oxygène), c'est du sol lunaire artificiel qui a été utilisé. Nous pouvons avoir confiance dans la fidélité de ce sol simulé puisque justement les centaines de kilogrammes d'échantillons lunaires rapportés par le programme Apollo nous ont permis de bien connaître le régolithe lunaire.

Sur le côté gauche de cette image se trouve un tas de régolithe lunaire simulé ; à droite, le même tas de sol lunaire après l'extraction de la quasi-totalité de l'oxygène que ces minéraux contiennent, ce qui laisse un mélange d'alliages métalliques. L'oxygène et le métal pourraient être utilisés par des colons sur la Lune. © Beth Lomax, University of Glasgow
De l'oxygène mais aussi des métaux pour les colons lunaires
Dans le procédé mis au point par Beth Lomax, un courant électrique parcourt un mélange d'une poudre de régolithe simulé dans du chlorure de calcium fondu à 950 °C de sorte que le régolithe demeure solide. La chimiste précise d'ailleurs à ce sujet que : « C'est le premier exemple de traitement direct "poudre à poudre" du régolithe lunaire solide simulé capable d'en extraire la quasi-totalité de l'oxygène. Les méthodes alternatives d'extraction de l'oxygène lunaire permettent d'obtenir des rendements nettement inférieurs ou nécessitent la fusion du régolithe à des températures extrêmes, supérieures à 1 600 °C. »
Le nouveau procédé semble vraiment efficace et prometteur. Pour s'en convaincre, on peut déjà dire qu'il suffit de 50 heures pour extraire 96 % de l'oxygène contenu dans un échantillon de régolithe, mais seulement 15 heures pour en extraire déjà 75 %.
En ce qui concerne les applications pour la métallurgie, on obtient trois groupes d'alliages principaux (parfois mélangés à de petites quantités d'autres métaux) à savoir deux alliages fer-aluminium et le fer-silicium et un autre de type calcium-silicium-aluminium. Surtout, ces alliages se présentent comme des phases facilement séparables, ce qui est favorable à des processus de raffinement permettant d'obtenir du fer, de l'aluminium et du calcium à l'état pur in fine.
En bonus, il n'y a pas de raison pour que la méthode utilisée ne soit pas transposable au régolithe martien.

Une photo montrant le régolithe lunaire lors de la mission Apollo 17. © Nasa/JSC/ALSJ
Produire de l'oxygène sur la Lune
Article de Rémy Decourt publié le 19/06/2005
Dans le cadre de la Nouvelle Vision de l'Espace, un ambitieux projet initié par le président Bush d'exploration spatiale, qui prévoit de retourner sur la Lune avant d'aller sur Mars, la NASA vient d'octroyer un contrat portant sur le développement de technologies capables de produire de l'oxygène à partir du régolite lunaire, cette couche poussiéreuse qui recouvre la surface de notre satellite naturel.
Les bénéficiaires de ce contrat sont Florida Tech, British Titanium, l'université de Cambridge et le Centre spatial Kennedy de la NASA.
L'oxygène est l'élément le plus abondant des roches lunaires mais un processus d'extraction est nécessaire avant d'envisager son utilisation. La NASA est engagée dans plusieurs projets qui visent tous à mettre au point un appareil capable de transformer la poussière lunaire en oxygène. L'Université de Cambridge et son laboratoire de Science des matériaux et métallurgie sont en pointe dans ce domaine d'où l'intérêt que leur porte la NASA.
Ce contrat vise à produire de l'oxygène à partir d'un processus mis au point par l'Université de Cambridge et connu sous le nom de Fray-Farthing-Chen (FFC) Cambridge qui utilise la réduction électrochimique d'oxydes métalliques dans un électrolyte de sel en fusion. L'utilisation de cette technologie est prometteuse parce qu'elle offre des possibilités intéressantes d'extraction de tout l'oxygène contenu dans le régolite à des températures plus basses que des processus concurrents qui apparaissent bien moins performants.
Une des clés de la réussite du retour de l'homme sur la Lune et de l'installation de base humaine lunaire, étape préalable à l'exploration de mondes plus lointains, comme Mars est la capacité qu'auront les astronautes de demain à utiliser au mieux les ressources naturelles de façon à les traiter industriellement pour répondre à leurs propres besoins.
Or, l'oxygène liquide est le composant principal de tout carburant de fusée. Il peut représenter jusqu'à 85 % de son poids total. Sa production sur la Lune permettrait ainsi de réduire la masse de tout véhicule à destination de la Lune, de réduire hautement les risques techniques afférents au transport de carburant.
A plus long terme, l'oxygène serait utilisé par les vaisseaux pour se ravitailler en vue de voyages bien plus loin, vers Mars , à la rencontre d'astéroïdes et au-delà, mais d'ici une petite centaine d'années.
Source: https://www.futura-sciences.com/
Lien: https://www.futura-sciences.com/sciences/actualites/univers-colonisation-lune-esa-teste-centrale-oxygene-6475/?fbclid=IwAR03NIAiv9q0uc6k621e88kdvFo-TCae9wPYnNdlJAt1YQGWKskF-oXRFDA#utm_content=futura&utm_medium=social&utm_source=facebook.com&utm_campaign=futura


























 Français
Français
 English
English
 Español
Español
 Italiano
Italiano
 Deutsch
Deutsch
 Nederlands
Nederlands
 Portuguesa
Portuguesa
 Swedish
Swedish
 Romanian
Romanian
 Polish
Polish
 Norwegian
Norwegian
 Finnish
Finnish
 Bulgarian
Bulgarian
 Danish
Danish
 Czech
Czech
 Croatian
Croatian
 Hindi
Hindi
 Russian
Russian
 Chinese (Simplified)
Chinese (Simplified)
 Japanese
Japanese
 Arabic
Arabic



